Дисфункция мейбомиевых желез является одной из причин развития синдрома сухого глаза. В предлагаемой статье автор представляет обзор литературы по проблеме диагностики и терапии этого состояния. Рассмотрены такие вопросы, как применение мейбографии и опросников для постановки диагноза, критерии оценки состояния, современные методы терапии. Дана рекомендация о необходимости включения скрининга дисфункции мейбомиевых желез в стандартный алгоритм обследования.
- Вступление
- Что такое ДМЖ?
- Когда развивается ДМЖ и почему ее замечают не сразу?
- Насколько распространена атрофия мейбомиевых желез у детей?
- Возможна ли регенерация МЖ?
- Заключение
Вступление
Дисфункция мейбомиевых желез (ДМЖ) – это наиболее частая причина возникновения синдрома сухого глаза, она встречается у 20 % европеоидов и 60 % азиатов от 40 до 60 лет [1]. Считается, что это состояние в основном влияет на пожилых людей, в некоторых научных работах оно связывается с началом менопаузы у женщин [2]. Но так ли это на самом деле? Появляется ли ДМЖ только в этот период? Или же это прогрессирующее состояние, которое начинается гораздо раньше?
Некоторые типы ДМЖ следует рассматривать так же, как пресбиопию и катаракту, – то есть как хроническое прогрессирующее состояние. Например, при пресбиопии первые проявления дефицита аккомодации происходят еще в детстве [3], а при формировании катаракты прозрачность хрусталика постепенно уменьшается с возрастом [4]. Лишь тогда, когда эти изменения достигают значимого уровня, при котором негативно влияют на функции организма, люди начинают на них жаловаться. Хотя амплитуда аккомодации снижается постепенно, люди начинают обращаться за помощью только тогда, когда ее уже недостаточно для комфортного чтения и работы на близком расстоянии [5]. Подобным образом возрастное формирование катаракты, возникающее из-за хронического влияния ультрафиолетового излучения, постепенно ухудшает структуру хрусталика, его прозрачность, вызывает рассеяние световых лучей [6], но люди обращаются к офтальмологу лишь тогда, когда серьезно затронуты острота зрения и контрастная чувствительность, вырастает чувствительность к световым бликам [7]. Как и в случае этих состояний, диагностика которых осуществляется регулярно при проверке бинокулярной аккомодации и вергенции или оценке хрусталика с помощью биомикроскопа, для ранней диагностики ДМЖ нужна скрининговая программа.
Блэки (Blackie) и соавторы в своем обзоре подчеркивают, что ДМЖ может включать в себя неочевидный гипосекреторный обструктивный тип, при котором обнаружение воспаления и других признаков патологии возможно лишь с помощью специальных методов обследования [8]. Это говорит и о том, что ДМЖ – это такое состояние, скрининг которого следует проводить с помощью подходящих для этого клинических тестов. Переосмысление ДМЖ в этом ключе также может помочь нам понять, почему так много людей испытывают дискомфорт при ношении контактных линз уже в молодом возрасте [9].
Что такое ДМЖ?
ДМЖ – это хроническая диффузная аномалия мейбомиевых желез (МЖ), обычно характеризующаяся закупоркой выводных протоков или изменениями в выделяемом ими секрете, что может приводить к изменению состава слезной пленки, клинически значимому воспалению, заболеваниям глазной поверхности и симптомам раздражения глаза [10]. Подозрение офтальмолога или оптометриста на ДМЖ, как правило, возникает после перечисления пациентом характерных для нее симптомов. Однако известно, что выраженность сообщаемых симптомов и наблюдаемые клинические признаки не всегда соответствуют друг другу [11]. Более того, число пациентов с бессимптомной формой ДМЖ превышает число их с симптомами: бессимптомных пациентов примерно в 3 раза больше [12]. Еще больше затрудняет этиопатогенетический подход к лечению тот факт, что часто назначаемое лечение нейтрализует или уменьшает степень выраженности симптомов, но не влияет на причины состояния [13].
Для помощи врачам в диагностике синдрома сухого глаза составлены многочисленные опросники, но тем не менее очень часто выставляемые в них баллы вырастают только в относительно тяжелых случаях, а для ранней диагностики ДМЖ специальные опросники вообще не разрабатывались. Это особенно верно в отношении ДМЖ обструктивного типа, при которой не наблюдаются воспалительные процессы и которая протекает в основном бессимптомно, пока не достигнет выраженной степени. Например, опросник «Индекс заболевания глазной поверхности» (OSDI – Ocular Surface Disease Index) содержит вопросы, ответы на которые позволяют определить степень выраженности симптомов сухого глаза и их воздействие на зрительные функции [14], но в нем нет специальных вопросов о слезопродукции и об ощущении инородного тела, которые свойственны ДМЖ.
Опросник «Индекс глазного комфорта» (OCI – Ocular Comfort Index) разрабатывался для того, чтобы оценивать степень дискомфорта в баллах на основании модели Раша, но получаемые баллы сложно совместить с клинической картиной [15]. Опросник «Стандартный опрос пациента о сухости глаз» (SPEED – Standard Patient Evaluation of Eye Dryness Questionnaire) создавался для того, чтобы быстро получать представление о динамике отягощения симптоматики [16].
Все это говорит о том, что именно клиническая картина, полученная как часть скрининга состояния поверхности глаза, играет главную роль в диагностике ДМЖ. Среди клинических критериев можно назвать следующие: осмолярность слезной пленки выше 302 мОсм/л [17], длина нити, пропитанной феноловым красным, меньше 20 мм [18], время разрыва слезной пленки менее 10 с [19], покраснение поверхности глаза [20], прокрашивание роговицы или конъюнктивы [21], оценка качества и количества секрета желез [19].
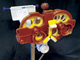
Однако объективизация представления о функциональном состоянии мейбомиевых желез или точное определение состояния желез возможны лишь при прямой их визуализации во время мейбографии [22]. Первые попытки проведения этой методики требовали размещения под нижним веком трансиллюминирующего источника инфракрасного излучения, в наши дни широкое распространение получили бесконтактные методы мейбографии [23]. В клинических условиях при этой методике получают данные в виде баллов (от 0–3, где 0 – это отсутствие потери, 1 – область потери меньше 1/3 общей площади желез, 2 – потеря между 1/3 и 2/3 общей площади, 3 – потеря более 2/3 общей площади желез) (рис. 1) [23]. В дальнейшем шкалы баллов и другие шкалы оценки состояния задней поверхности век будут усовершенствованы [24]. Несмотря на то что лучше всего проводить визуализацию желез с помощью инфракрасного излучения, в тех случаях, когда нет такой возможности, можно использовать красный светофильтр и программное обеспечение для обработки изображений; хотя при этом визуализация получается не такого хорошего качества, тем не менее она позволяет оценить функциональные потери мейбомиевых желез [25].

Рис. 1. Определение баллов. Во время мейбографии железы предстают в виде неровных линий в ткани века. В этом случае баллы = 1, поскольку площадь их потери меньше 1/3 площади века
Когда развивается ДМЖ и почему ее замечают не сразу?
Мейбомиевые железы играют важнейшую роль в создании качества слезной пленки, поскольку из их секрета образуются слои полярных и неполярных липидов [26]. При ДМЖ происходят постепенное уменьшение секреции и гипотрофия, и нередко это состояние не диагностируется специалистом, не использующим специальных методик и оборудования [27]. До тех пор пока вырабатывается хотя бы минимальное количество их секрета, качество слезной пленки сохраняется и симптомы ДМЖ редки. Однако, когда происходит значимое уменьшение секреции, продукции липидов начинает не хватать, слеза быстро испаряется, что вызывает включение адаптационно-приспособительного механизма увеличения секреции водно- муциновой фазы [28]. Постепенно пациенты начинают жаловаться на симптомы, но к этому моменту лишь немногие железы сохраняют свою функцию (рис. 2).

Рис. 2. Снимок правого глаза во время мейбографии у 50-летней женщины, которая никогда раньше не испытывала симптомов сухого глаза, до этого ДМЖ у нее не диагностировалась. Еще в молодости она замечала, что иногда у нее краснеет конъюнктива, но за помощью обратилась только сейчас, когда во время сна у нее стали слипаться веки. Атрофия желез явная, баллы = 3
Недостаток липидов в слезе и вдоль края века может приводить к слипанию век во время ночного сна [1], поскольку высыхающий секрет действует как клеящая субстанция. Возможно даже прилипание границ век к роговице, и, если не предпринять меры, во время открытия глаз пациент почувствует сильную боль, вызванную срывом клеток эпителия. На ранних стадиях ДМЖ не причиняет большого дискомфорта, и человек может не осознавать ее настоящее значение. Показательным клиническим признаком состояния служит горизонтальная линия в эпителии роговицы на уровне границы века (рис. 3). При ее появлении возможно возникновение повторяющихся эрозий эпителия. У 60 % пациентов с синдромом рецидивирующих эрозий роговицы диагностируется ДМЖ [29]. Запускается воспалительный каскад, глаза краснеют, выглядят раздраженными [30].

Рис. 3. Прилипание края века к роговице может привести к появлению горизонтальной линии потери эпителиальных клеток, которую можно визуализировать при использовании флуоресцеина. Даже если ее выраженность слабая, специалисту следует провести осмотр век и выяснить статус мейбомиевых желез
На этом этапе пациент, столкнувшийся с ДМЖ, наверняка обратится к врачу, в таком случае решают проблему с помощью препаратов искусственной слезы, глазных капель, гелей и мазей, чтобы контролировать симптомы [31]. Тепловые компрессы, массаж век и их экспрессия [31], специальные паровые устройства [32], медовые глазные капли [33], интенсивный пульсирующий свет [34], очистка края век [35] и другие терапевтические методы назначаются в целях улучшения функций желез. Возможно применение препаратов с омега-3 жирными кислотами и витамином D [36, 37].
Но насколько эффективно лечение на данной стадии и возможно ли вообще перманентное устранение ДМЖ? Даже при применении теплового воздействия и экспрессии век секрет не так легко выходит из желез (рис. 4). В большинстве случаев терапия ведет к купированию симптомов, но не причин, при этом она занимает дополнительное время, и проводить ее приходится всю оставшуюся жизнь. В метаанализе рандомизированных клинических исследований было показано, что только системное применение антимикробных препаратов (миноциклина, азитромицина, доксициклина) ведет к значимому уменьшению признаков ДМЖ [38]. При этом многие исследования методов терапии были исключены из метаанализа из-за недостатков в дизайне (отсутствие рандомизации, анализа ретроспективных записей).

Рис. 4. Экспрессия МЖ после тепловой терапии. В тех случаях, когда есть обструкция или атрофия желез, у выходных отверстий не наблюдается маслянистого секрета
Насколько распространена атрофия мейбомиевых желез у детей?
Специалистов очень волнует тот факт, что атрофия мейбомиевых желез может развиваться у детей бессимптомно, в результате чего ранние стадии ДМЖ остаются недиагностированными. Лишь несколько исследований посвящены распространению ДМЖ у детей. В одном из них приняли участие 99 детей от 4 до 17 лет, у которых в анамнезе не было синдрома сухого глаза [39]. Исследование показало, что у 40 % детей наблюдалась атрофия желез, хотя при применении опросника SPEED симптомы не выявлялись. И это не необычные результаты. В возрастной группе 15 лет отмечались морфологические изменения в мейбомиевых железах [40]. Авторы заметили, что в этой группе детей, живущих в Японии, показатели ДМЖ были хуже, чем ожидалось: баллы = 2,8 ± 1,2, оценка качества секрета = 1,8 ± 1,2 (при норме баллов – от 0 до 1).
Конечно, синдром сухого глаза у детей возникает по многим причинами [41]. Специалист может обнаружить у них ранние признаки воспаления поверхности глаза, особенно на назальной конъюнктиве и внизу ее – рядом с ребром века. Оно может быть вызвано загрязнением воздуха, длительным использованием электронных устройств, которое ведет к уменьшению частоты морганий, или же слабыми хроническими воспалительными процессами. Существуют подтвержденные данные о связи продолжительного применения электронных устройств и синдрома сухого глаза. Мун (Moon) и соавторы провели перекрестное исследование с участием 916 детей, во время которого проверялась взаимосвязь между синдромом сухого глаза и временем использования гаджетов [42]. Их работа показала, что в группе с синдромом сухого глаза дети в течение дня более длительно использовали электронные устройства, а уменьшение этого времени благотворно сказывалось на симптомах и признаках.
В одном исследовании обнаружено, что каждый час использования смартфона ведет к росту числа неполных смыканий век при моргании: с 6 до 15 в минуту [43]. Говоря о ДМЖ, важно отметить рост неполных смыканий при пользовании смартфоном. В исследовании Вен (Wan) и соавторов участвовали дети с односторонним параличом лицевого нерва, и ученые выяснили, что неполное смыкание век ведет к ухудшению качества секрета желез и плохой их экспрессии [44]. Неполное смыкание век может вести к атрофии МЖ и их потере из-за развития стазиса липидов и обструкции желез. Когда возникает блокада отверстий желез, происходит скопление секрета и железа теряет функциональность [45].
Включение визуализации МЖ в качестве скрининга с раннего возраста дает возможность наблюдать за железами, выявлять изменения на ранней стадии, например укорачивание желез и уменьшение площади, занимаемой ими, и назначать профилактическую терапию. Также необходимо рекомендовать детям уменьшать время пользования электронными устройствами и упражнения для улучшения моргания.
Возможна ли регенерация МЖ?
Принято считать, что в случае потери функций и уменьшения длины железы не восстанавливаются. Есть ли данные, свидетельствующие об обратном? Если атрофию желез можно предотвратить или обратить вспять, верно ли это лишь в случаях слабой ДМЖ (1 и 2 степени) или же улучшения возможны и в выраженной стадии заболевания (3 степень и выше)? Ноп (Knop) и соавторы рассмотрели анатомию, физиологию и патофизиологию МЖ и описали, насколько они подвержены обструкции, давлению и атрофии и замкнутому циклу субклинического воспаления [45]. Однако ничего не сказали о том, возможна ли их регенерация.
Ин и Гонг (Yin, Gong) показали, что проведение гигиены век в течение одного месяца (прогревание век с последующим массажем и чисткой) способно улучшить экспрессию желез и ведет к снижению атрофии МЖ на 5 % (данные получены на основании мейбографии у пациентов с ДМЖ 2 или 3 степени) [46]. Авторы также отмечают морфологические улучшения желез на снимках. Однако одна треть пациентов не придерживались рекомендаций терапии, и у них, как и ожидалось, улучшения не были заметны. Ин и Гонг пишут и о том, что им неясно, возможно ли обратить вспять атрофию МЖ при тяжелой степени ДМЖ. Жиллон (Guillon) и соавторы показали, что проведение гигиены век с помощью специальных накладок на глаза (содержащих каприлоил глицин и Iris florentina) способно улучшить функцию желез и уменьшить их атрофию у большинства пациентов [47]. Терапия интенсивным пульсирующим светом может вести к улучшениям в случае ДМЖ, в частности их экспрессии, уменьшать атрофию желез (при средней степени ДМЖ – 2-й или 3-й) [48]. Применение устройства LipiFlow разжижает застывший секрет и снимает обструкцию протоков желез, а совмещаемый с ним прибор LipiScan дает возможность визуализации МЖ [49]. Лучшие результаты, как правило, в терапии ДМЖ отмечаются на ранних стадиях заболевания. И опять же не у всех пациентов наблюдаются улучшения.
Исследователи изучали и более инвазивные методы терапии. Существует определенный потенциал у процедуры механической очистки границ века и линии Маркса, снимающей обструкцию выводных протоков желез. Корб и Блэки (Korb, Blackie) показали, что механическая очистка покрытой кератином границы века дает возможность открыть отверстия желез, что через месяц приводит к улучшению функций мейбомиевых желез [35]. Однако при этом исследователями не проводилась визуализация желез, поэтому нет данных о том, происходила ли в этом случае регенерация МЖ. Еще более инвазивный метод, в котором используется стерильная стальная игла для взаимодействия с МЖ, не привел к росту и регенерации ткани желез [50]. Цель воздействия на железы в этом случае заключалась в том, чтобы устранить обструкцию железы по ее протяженности и восстановить нормальный поток секрета. На 13 веках с идентифицированными 149 железами отмечалось увеличение на 6,4 % общей площади, занимаемой МЖ, и на 6,2 % – индивидуальной площади желез, все это наблюдалось в период от 4,5 до 12 месяцев после проведения процедуры. Таким образом, есть некоторые данные о том, что регенерация желез возможна. Однако трудности существуют в том, как обучиться данной методике, не говоря уже и о том, что нелегко будет убедить пациента пройти такую процедуру. Регенерация мейбомиевых и слезных желез возможна с помощью стволовых клеток [51], но вряд ли эта методика станет доступной в ближайшее время.
Все это означает, что проведение терапии в молодом возрасте, то есть профилактики развития ДМЖ, пока остается лучшей тактикой лечения. Популярность же получит тот метод лечения, который пациентам будет легко использовать: недорогой и действующий на причину атрофии МЖ.
Заключение
Визуализация МЖ с помощью мейбографии улучшает качество медицинской помощи, оказываемой пациентам с ДМЖ, поскольку дает возможность диагностики состояния на раннем этапе. Бессимптомные пациенты, даже дети, нуждаются в скрининге ДМЖ с помощью мейбографии или экспрессии желез. Снимки желез можно использовать для обсуждения состояния с пациентом, даже если у него нет симптомов. Мейбография – это бесконтактный метод, поэтому ее следует включить в стандартный алгоритм офтальмологического или оптометрического обследования. Появление недорогих компактных и, возможно, мобильных устройств для проведения мейбографии будет этому способствовать.
Ранняя диагностика – это, конечно, лишь один из этапов профилактики синдрома сухого глаза, вызываемого ДМЖ. Нам необходим метод терапии, с которым пациенты легко справятся, который будет воздействовать на причину атрофии МЖ и тем самым предотвращать прогрессирование состояния. Пока ни один из существующих методов не отвечает всем этим критериям. Предлагайте пациентам хотя бы несколько простых действий, таких как сокращение времени использования экрана, тренировка моргания и нагревание с массажем век, для профилактики ДМЖ.
Список литературы
1. Schaumberg DA, Nichols JJ, Papas EB et al. The international workshop on Meibomian gland dysfunction: report of the subcommittee on the epidemiology of and associated risk factors for MGD. Invest Ophthalmol Vis Sci 2011 52: 1994–2005.
2. Versura P and Campos EC. Review. Menopause and dry eye. A possible relationship. Gynecol Endocrinol 2005 20: 289–298.
3. Kasthurirangan S and Glasser A. Age related changes in accommodative dynamics in humans. Vision Research 2006 46: 1507–1519.
4. Pierscionek B, Bahrami M, Hoshino M, et al. The eye lens: age-related trends and individual variations in refractive index and shape parameters. Oncotarget 2015 6: 30532–30544.
5. Charman WN. Developments in the correction of presbyopia I: spectacle and contact lenses. Ophthalmic Physiol Opt 2014 34: 8–29.
6. Behar-Cohen F, Baillet G, de Ayguavives T, et al. Ultraviolet damage to the eye revisited: eye-sun protection factor (E-SPF®), a new ultraviolet protection label for eyewear. Clin Ophthalmol 2014 8: 87–104.
7. Chua J, Lim B, Fenwick EK, et al. Prevalence, risk factors, and impact of undiagnosed visually significant cataract: the Singapore epidemiology of eye diseases study. PLOS ONE 2017 12 (1): e0170804.
8. Blackie CA, Korb DR, Knop E, et al. Nonobvious obstructive meibomian gland dysfunction. Cornea 2010 29: 1333–1345.
9. Dumbleton K, Caffery B, Dogru M, et al. The TFOS international workshop on contact lens discomfort: report of the subcommittee on epidemiology. Invest Ophthalmol Vis Sci 2013 54 (11): TFOS20–TFOS36.
10. Nelson JD, Shimazaki J and Benítez del Castillo JM. The international workshop on meibomian gland dysfunction: report of the definition and classification subcommittee. Invest Ophthalmol Vis Sci 2011 52: 1930–1937.
11. Song H, Zhang M, Hu X, et al. Correlation analysis of ocular symptoms and signs in patients with dry eye. J Ophthalmol 2017 2017: 1247138.
12. Viso E, Rodríguez-Ares MT, Abelenda D, et al. Prevalence of asymptomatic and symptomatic Meibomian gland dysfunction in the general population of Spain. Invest Ophthalmol Vis Sci 2012 53: 2601–2606.
13. Cuevas M, González-García MJ, Castellanos E, et al. Correlations among symptoms, signs, and clinical tests in evaporative-type dry eye disease caused by meibomian gland dysfunction (MGD). Curr Eye Res 2012 37: 855–863.
14. Schiffman RM and Christianson MD, Jacobsen G, et al. Reliability and validity of the Ocular Surface Disease Index. Arch Ophthalmol 2000 118: 615–621.
15. Johnson ME and Murphy PJ. Measurement of ocular surface irritation on a linear interval scale with the ocular comfort index. Invest Ophthalmol Vis Sci 2007 48: 4451–4458.
16. Ngo W, Situ PMB, Nancy K, et al. Psychometric properties and validation of the standard patient evaluation of eye dryness questionnaire. Cornea 2013 32: 1204–1210.
17. Sullivan BD, Whitmer D, Nichols KK, et al. An objective approach to dry eye disease severity. Invest Ophthalmol Vis Sci 2010 51: 6125–6130.
18. Saleh TA, McDermott B, Bates AK, et al. Phenol red thread test vs Schirmer’s test: a comparative study. Eye 2006 20: 913–915.
19. Tomlinson A, Bron AJ, Korb DR, et al. The international workshop on meibomian gland dysfunction: report of the diagnosis subcommittee. Invest Ophthalmol Vis Sci 2011 52: 2006–2049.
20. Foulks GN and Bron AJ. Meibomian gland dysfunction: a clinical scheme for description, diagnosis, classification and grading. Ocular Surf 2003 1: 107–126.
21. Bron AJ, Evans VE, and Smith J. Grading of corneal and conjunctival staining in the context of other dry eye tests. Cornea 2003 22: 640–650.
22. Wise RJ, Sobel RK, and Allen RC. Meibography: A review of techniques and technologies. Saudi J Ophthalmol 2012 26(4): 349–356.
23. Arita R, Itoh K, Inoue K, et al. Noncontact infrared meibography to document age-related changes of the meibomian glands in a normal population. Ophthalmology 2008 115: 911–915.
24. Arita R, Minoura I, Morishige N, et al. Development of definitive and reliable grading scales for meibomian gland dysfunction. Am J Ophthalmol 2016 169: 125–137.
25. Lee SM, Park I, Goo Y, et al. Validation of alternative methods for detecting meibomian gland dropout without an infrared light system. Red filter for simple and effective meibography. Cornea 2019 8: 574–580.
26. Mishima S and Maurice DM. The oily layer of the tear film and evaporation from the corneal surface. Exp Eye Res 1961 1: 39–45.
27. Yeotikar NS, Zhu H, Markoulli M; et al. Functional and morphologic changes of Meibomian glands in an asymptomatic adult population. Invest Ophthalmol Vis Sci 2016 57(10): 3996–4007.
28. Arita R, Morishige N, Koh S, et al. Increased tear fluid production as a compensatory response to meibomian gland loss: a multicenter cross-sectional study. Ophthalmology 2015 122: 925–933.
29. Diez-Feijóo E, Grau AE, Abusleme EI, et al. Clinical presentation and causes of recurrent corneal erosion syndrome: review of 100 patients. Cornea 2014 33: 571–575.
30. Yamaguchi T. Inflammatory response in dry eye. Invest Ophthalmol Vis Sci 2018 59 (14): DES192–DES199.
31. Geerling G, Tauber J, Baudouin C, et al. The international workshop on meibomian gland dysfunction: report of the subcommittee on management and treatment of meibomian gland dysfunction. Invest Ophthalmol Vis Sci 2011 52: 2050–2064.
32. Doan S, Chiambaretta F, Baudouin C; ESPOIR study group. Evaluation of an eyelid warming device (Blephasteam) for the management of ocular surface diseases in France: the ESPOIR study. J Fr Ophtalmol 2014 37: 763–772.
33. Albietz J and Schmid KL. Randomised controlled trial of topical antibacterial Manuka (Leptospermum species) honey for evaporative dry eye due to meibomian gland dysfunction. Clin Exp Optom 2017 100: 603–615.
34. Albietz JM and Schmid KL. Intense pulsed light treatment and meibomian gland expression for moderate to advanced meibomian gland dysfunction. Clin Exp Optom 2018 101: 23–33.
35. Korb DR and Blackie CA. Debridement‐scaling: a new procedure that increases meibomian gland function and reduces dry eye symptoms. Cornea 2013 32: 1554–1557.
36. The Dry Eye Assessment and Management Study Research Group. n−3 fatty acid supplementation for the treatment of dry eye disease. N Engl J Med 2018 378: 1681–1690.
37. Yang C-H, Albietz J, Harkin DG, et al. Impact of oral vitamin D supplementation on the ocular surface in people with dry eye and/or low serum vitamin D. Contact Lens Ant Eye 2018 41: 69–76.
38. Sridharan K and Sivaramakrishnan G. Therapies for meibomian gland dysfunction: A systematic review and meta-analysis of randomized controlled trials. Open Ophthal J 2017 11: 346–354.
39. Gupta PK, Stevens MN, Kashyap N, et al. Prevalence of meibomian gland atrophy in a pediatric population. Cornea 2018 37: 426–430.
40. Mizoguchi T, Arita R, Fukuoka S, et al. Morphology and function of meibomian glands and other tear film parameters in junior high school students. Cornea 2017 36: 922–926.
41. Alves M, Dias AC, and Rocha EM. Dry eye in childhood: epidemiological and clinical aspects. Ocul Surf 2008 6: 44–51.
42. Moon JH, Kim KW, and Moon NJ. Smartphone use is a risk factor for pediatric dry eye disease according to region and age: a case control study. BMC Ophthalmol 2016 16: 188.
43. Golebiowski B, Long J, Harrison K, et al. Smartphone use and effects on tear film, blinking and binocular vision. Curr Eye Res 2020 45 (4): 428–434.
44. Wan T, Jin X, Lin L, et al. Incomplete blinking may attribute to the development of Meibomian gland dysfunction. Curr Eye Res 2016 41: 179–185.
45. Knop E, Knop N, Millar T, et al. The international workshop on meibomian gland dysfunction: Report of the subcommittee on anatomy, physiology, and pathophysiology of the Meibomian gland. Invest Ophthalmol Vis Sci 2011 52: 1938–1978.
46. Yin Y and Gong L. Reversibility of gland dropout and significance of eyelid hygiene treatment in Meibomian gland dysfunction. Cornea 2017 36: 332–337.
47. Guillon M, Maissa C, and Wong S. Eyelid margin modification associated with eyelid hygiene in anterior blepharitis and meibomian gland dysfunction. Eye Contact Lens 2012 38: 319–325.
48. Yin Y, Liu N, Gong L, et al. Changes in the Meibomian gland after exposure to intense pulsed light in Meibomian gland dysfunction (MGD) patients. Curr Eye Res 2018 43: 308–313.
49. Robertson K. Guide to using Lipiflow to treat meibomian gland dysfunction. NewGradOptometry 2019 Nov 11. https://newgradoptometry.com/guide-to-using-lipiflow-to-treat-meibomian-gland-dysfunction/ [Accessed 23/03/2020].
50. Maskin SL and Testa WR. Growth of meibomian gland tissue after intraductal meibomian gland probing in patients with obstructive meibomian gland dysfunction. Brit J Ophthalmol 2018 102: 59–68.
51. Villatoro AJ, Fernández V, Claros S, et al. Regenerative therapies in dry eye disease: from growth factors to cell therapy. Int J Mol Sci 2017 18: e2264.
Автор:
Катрина Шмид, доцент кафедры оптометрии и науки о зрении Университета Квинсленда (Квинсленд, Австралия)
Перевод: И. В. Ластовская
© РА «Веко»
Печатная версия статьи опубликована в журнале «Современная оптометрия» [2020. № 10 (139)].
По вопросам приобретения журналов и оформления подписки обращайтесь в отдел продаж РА «Веко»:
- Тел.: (812) 603-40-02.
- E-mail: magazine@veko.ru
- veko.ru
Наши страницы в соцсетях: