Контроль миопии в настоящее время широко обсуждается в профессиональной прессе. В данной статье автор рассматривает методы измерения передне-задней оси глаза в целях выявления риска развития миопии и контроля ее роста.
- Введение
- Основания
- Измерение прогрессирования миопии
- Инструменты для измерения ПЗО
- Когда использовать оптический биометр при контроле миопии
- Нормальный рефрактогенез при эмметропии
- Когда ребенок уже миоп
- Что нужно учитывать
- Заключение
Введение
Контроль миопии – горячая тема. Данные исследований свидетельствуют, что прогрессирование миопии в детском возрасте может быть замедлено, поэтому среди специалистов обсуждение близорукости переходит из области простой коррекции зрительных функций в поле контролируемого процесса рефрактогенеза. Порой даже возникает вопрос: насколько оправдана простая оптическая коррекция прогрессирующей миопии, если мы можем замедлять ее рост? Основываясь на накопленной доказательной базе, мы приходим к выводу о необходимости контроля миопии, о скорейшей интеграции появляющихся новых методов в клиническую практику. В связи с этим встает другой вопрос – как проводить измерения прогрессирования миопии и оценивать эффективность его замедления.
Основания
Миопия, как правило, начинает развиваться в детстве, ее прогрессирование длится почти до окончания подросткового возраста. Обычно близорукость является результатом несоответствия размера глаза его оптической системе, а прогрессирование выражается в увеличении длины передне-задней оси (ПЗО). Сильная корреляция между прогрессированием миопии и ростом ПЗО хорошо задокументирована [1–3]. Хотя саму рефракционную ошибку можно исправить с помощью очков, контактных линз или лазерной хирургии, такая коррекция зрения не затрагивает глубинных процессов, приводящих к увеличению длины глаза. Траты на простую оптическую коррекцию зрения значительны. Одновременно рост распространенности миопии неизбежно ведет к увеличению фиксируемого числа ее тяжелых осложнений, которые также ложатся тяжким бременем на бюджет пациента и государства. Миопия высокой степени – более 6,00 дптр – уже долгое время ассоциируется с такими угрожающими зрению состояниями, как миопическая макулопатия, отслойка сетчатки, катаракта и глаукома. Тем не менее выбор указанного порога случаен, на самом деле и при менее выраженной миопии риск таких патологий высокий [4]. Основным фактором ухудшения зрения при миопии, похоже, является размер ПЗО. У глаза с величиной ПЗО более 26 мм риск тяжелого ухудшения зрительных функций составляет 25 %, а если ПЗО больше 30 мм, он устремляется к 90 % [5, 6].
Измерение прогрессирования миопии
Контроль миопии требует от клиники проведения точных измерений рефракционной ошибки у детей с циклоплегией, а также динамического наблюдения больных для мониторинга изменений. Точное измерение ПЗО, если оно возможно, также следует считать очень важным для обеспечения эффективности контроля близорукости. Если взять все это вместе, то получается, что для того, чтобы грамотно заниматься контролем миопии, нужно быть в курсе современных исследований в этой области и уметь применять их результаты на практике, учитывая такие аспекты, как возраст пациента, факторы риска, анамнез и среда, степень рефракционной ошибки и размер ПЗО [7, 8].
В оптометрической практике мы привыкли измерять рефракционную ошибку, это ядро нашей деятельности, а вот измерение ПЗО для нас необычно. Давайте рассмотрим, с помощью каких инструментов можно проводить мониторинг изменений ПЗО и как они используются в практике контроля миопии.
Инструменты для измерения ПЗО
На рынке представлен некоторый ассортимент таких приборов. Методы измерения ПЗО можно разделить на ультразвуковую и оптическую биометрию и оптическую когерентную томографию (ОКТ).
Ультразвуковая биометрия
Исторически сложилось так, что именно ультразвуковые методы первыми стали использоваться в исследованиях миопии для измерения ПЗО [8, 9]. Суть метода заключается в направлении с помощью зонда высокочастотных звуковых волн (примерно 10 МГц) в глаз. Прибор регистрирует время задержки отраженных от тканей волн и преобразует полученные данные в геометрическое расстояние, основываясь на значениях скорости звука в той или иной среде. Ультразвуковые приборы проводят измерение ПЗО от передней поверхности роговицы до внутренней, ограничивающей мембраны сетчатки (так называемый А-скан).
Негативным аспектом такой технологии является необходимость контакта зонда с глазом обследуемого. Точность измерений с помощью ультразвука составляет примерно 0,1 мм [10], а воспроизводимость результатов находится в пределах 0,2–0,3 мм [11, 12]. Если считать, что каждые 0,1 мм изменения длины ПЗО эквивалентны изменению рефракции примерно на 0,30 дптр, то становится ясно, что точность ультразвукового измерения для наших задач при контроле миопии не самая лучшая. Помимо этого, процедура сканирования требует анестезии, а результаты измерения зависят от умений оператора сориентировать зонд вдоль оси глаза. Все это снижает возможность применения А-скана для мониторинга изменений длины ПЗО во время контроля миопии у детей.
В связи с описанными ограничениями ультразвуковой биометрии в сфере изучения миопии постепенно перешли на использование других методик измерения ПЗО, основанных на оптике. Тем не менее ультразвуковые сканеры сохраняют свою роль в других областях оптометрии и офтальмологии, например для измерения ПЗО в случае плотной катаракты или отека роговицы, то есть тогда, когда оптическая биометрия бессильна. К тому же при ультразвуковом сканировании пациенту не требуется фиксировать взгляд на мишени.
Оптическая биометрия
Оптические биометры, принцип действия которых основан на частично когерентной интерферометрии (ЧКИ), дают возможность бесконтактного измерения ПЗО [13], что является большим преимуществом этих приборов при работе с детьми. Аппарат направляет два частично когерентных пучка лазерного излучения в глаз, лучи отражаются от тканей глаза. Происходит интерференция, формируется интерференционная картина в виде характерных колец, пики яркости соответствуют тем или иным структурам органа зрения. Данные конвертируются в геометрическое представление с учетом значений показателя преломления разных тканей глаза. Такие оптические биометры измеряют ПЗО от передней поверхности роговицы до пигментного эпителия сетчатки.
Клинические преимущества оптических биометров перед ультразвуковыми сканерами следующие: процедура бесконтактная, не требуется анестезия, отсутствует риск травмирования роговицы от аппликации зонда, процедура более проста для пациента, прибор имеет высокую точность измерений – 0,01 мм, что на порядок выше, чем у ультразвукового прибора [14].
В литературе можно найти данные о том, что циклоплегия позволяет улучшить воспроизводимость результатов, небольшое изменение значения измеренной ПЗО связано с аккомодацией [15].
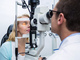
В ходе недавних исследований, посвященных контролю миопии, использовали биометр IOLMaster 500 (Carl Zeiss Meditec, Йена, Германия; рис. 1), работающий на основе ЧКИ [16, 17]. Он давал сравнимые с ультразвуковым сканером значения длины ПЗО, но с существенно большей точностью [18]. Данный прибор измеряет оптические пути, после чего преобразует их в размер ПЗО, исходя из среднего показателя преломления тканей глаза.

Рис. 1. Оптический биометр IOLMaster 500 (Carl Zeiss Meditec, Германия)
Ряд исследований говорит о хорошей воспроизводимости результатов измерений на IOLMaster 500 и об их высокой точности: в 95 % пар «тест – повторный тест» результаты совпадали на ± 0,04 мм [12]. Такой уровень воспроизводимости результатов и высокая точность делают данный прибор золотым стандартом в измерении ПЗО. Во всем мире о нем отзываются как о безопасном и точном приборе для измерения ПЗО у взрослых и детей [12, 19].
На рынке также представлены и другие оптические биометры, работающие на основе ЧКИ и выпущенные уже после IOLMaster 500. Инструмент AL-Scan (Nidek Co., Ltd., Гамагори, Япония) имеет несколько функций: он совмещает ЧКИ для измерения ПЗО и шаймпфлюг-камеру для оценки параметров переднего отрезка глаза. Биометр Galilei G6 (Ziemer, Порт, Швейцария) соединяет в себе измеритель ПЗО на основе интерферометрии, роговичный топограф с кольцом Пласидо и также шаймпфлюг-камеру для исследования переднего отрезка глаза. В приборе Pentacam AXL (Oculus Optikgeräte GmbH, Ветцлар, Германия) объединены измеритель ПЗО на основе ЧКИ и шаймпфлюг-камера. Измерения ПЗО этими приборами также обладают высокой воспроизводимостью, сравнимой с таковой у IOLMaster 500. Работа оптического биометра Lenstar LS 900 (Haag-Streit, Кёниц, Швейцария) основана на тех же принципах, что и IOLMaster 500, однако в качестве источника света в нем используется сверхъяркий диод (в то время как в IOLMaster 500 – лазерный диод); это позволяет измерять с помощью данного прибора не только ПЗО, но и толщину роговицы в центре, глубину передней камеры и толщину хрусталика. Такой расширенный набор измеряемых параметров дает более глубокое понимание характеристик глаза. Ряд исследований также показал, что биометр Lenstar LS 900 обеспечивает высокую точность измерения ПЗО, сравнимую по точности и воспроизводимости результатов с IOLMaster 500 [20].
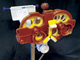
Недавно на рынке появился биометр Aladdin (Topcon, Токио, Япония). В нем совмещены роговичный топограф на основе диска Пласидо, а также измеритель ПЗО, толщины роговицы в центре, глубины передней камеры и толщины хрусталика на основе ЧКИ (рис. 2). Это простой в использовании и быстрый биометр, дающий точные и воспроизводимые результаты, сравнимые с IOLMaster 500 [21]. Данный биометр имеет дополнительную возможность – измерение топографии роговицы, что также полезно для контроля миопии с помощью ортокератологии.

Рис. 2. Оптический биометр Aladdin (Topcon, Япония)
Для мониторинга изменений ПЗО можно использовать и ОКТ. Как и инструменты, основанные на ЧКИ, топографы обеспечивают быстрое и точное измерение ПЗО [22]. Их преимущество перед оптическими биометрами заключается в том, что они дают картину глаза в сечении, показывая все ткани глаза, тем самым предоставляя дополнительную биометрическую информацию. Прибор IOLMaster 700 (Carl Zeiss Meditec, Йена, Германия), работающий на алгоритмах Фурье, обеспечивает высокоточные измерения ПЗО, сравнимые с данными биометров; помимо этого, он определяет толщину роговицы в центре, глубину передней камеры и толщину хрусталика на основе ЧКИ [23]. Среди новых ОКТ-приборов можно назвать AO-2000 (Tomey, Нагоя, Япония) и Argos (Movu, Inc., Санта-Клара, США).
Общее об оптических биометрах
Инструменты оптической биометрии хорошо подходят для мониторинга прогрессирования роста ПЗО у детей, это бесконтактные и простые в использовании приборы. Высокая точность позволяет отслеживать малейшие изменения размера ПЗО. На рынке представлен достаточно широкий ассортимент оптических биометров, большинство из них обладают схожей точностью измерений и воспроизводимостью результатов.
Когда использовать оптический биометр при контроле миопии
Оптический биометр при контроле миопии у детей следует применять всегда, это же касается и взрослых с прогрессирующей миопией. Полученные с его помощью данные дадут полную картину динамики роста ПЗО, а в случае взрослых пациентов помогут определить, является ли прогрессирующая миопия осевой.
Неплохо воспользоваться им и при обследовании ребенка в предмиопическом статусе – это дети, у которых выявлены факторы риска развития миопии. К таковым относятся наличие одного или двух миопических родителей и меньшей гиперопии, чем ожидается в данном возрасте (меньше 0,75 дптр при циклоплегии в возрасте 6–9 лет) [7, 8]. Одним из ключевых открытий крупномасштабных научных исследований стало то, что наиболее быстрые изменения рефракции происходят в год перед дебютом миопии [8]. Поэтому, помимо миопического сдвига в гиперметропии, можно получить дополнительные данные об изменении ПЗО у детей, находящихся в группе риска. В настоящее время на основе доказательств считается, что у них следует регулярно измерять рефракционную ошибку и ПЗО каждые шесть месяцев.
Нормальный рефрактогенез при эмметропии
Для того чтобы оценить рост ПЗО у детей с миопией, необходимо понимать нормальные уровни роста их глаз с возрастом. Зэдник (Zadnik) и соавторы провели научное исследование нормального роста глаза у эмметропических детей [9]. Они измеряли с помощью ультразвука ПЗО у 194 детей в возрасте 6–14 лет (результаты приведены в табл.). Хотя ультразвуковые измерения обладают бóльшей вариабельностью, чем замеры на основе ЧКИ, количество наблюдений в данном случае компенсировало возможные ошибки. Результаты оказались сравнимыми с исследованием Фледелиуса (Fledelius) и соавторы, согласно которому ежегодный рост ПЗО у мальчиков в возрасте 8 лет составил 0,17 мм, а у девочек – 0,16 мм [24]. Важно понимать, что даже у подростков в 16 лет исследователи группы Зэдник выявили рост ПЗО, пусть и в более медленном темпе (0,07 мм – у мальчиков и 0,04 мм – у девочек). Считается, что эмметропия сохраняется в том случае, когда рост ПЗО соотносится с увеличением оптической силы хрусталика. А хрусталик может компенсировать ускоренный рост ПЗО лишь до определенной границы. Таким образом, если оптическая биометрия показывает бóльший рост ПЗО, чем в данных исследованиях, то очень вероятно, что у данного ребенка начнет развиваться миопия. Это та самая информация, которой не хватало бы, если бы офтальмолог или оптометрист измерял только клиническую рефракцию глаза ребенка.
Когда ребенок уже миоп
Если у ребенка-эмметропа наблюдается рост ПЗО с детства и до окончания подросткового возраста, то у детей с миопией следует ожидать более быстрого увеличения ее размера.
Ведение графика роста ПЗО для каждого ребенка очень полезно. Во-первых, такой график позволит вам продемонстрировать родителям и самому ребенку то, как идет рост его глаза по сравнению с детьми-эмметропами. Во-вторых, он поможет представить доказательства эффективности выбранного метода контроля миопии. Если вы покажете родителям и ребенку, как происходит замедление роста глаза с начала вмешательства, это даст им уверенность в том, что овчинка стоила выделки. В-третьих, сам врач получает великолепную возможность наблюдать за рефрактогенезом и определить время окончания контроля миопии.
Что нужно учитывать
Были задокументированы значительные кратковременные или транзиентные изменения длины ПЗО. Они возникают вследствие физиологических факторов, например изменения величины ВГД или аккомодации [25, 26]. Поэтому нужно учитывать и такие факторы при мониторинге роста ПЗО; для их выявления необходимо делать измерения в одно и то же время дня, потенциально при циклоплегии. Применение оптических бесконтактных биометров – это довольно быстрая процедура; дети, как правило, с интересом участвуют в ней.
Заключение
В зависимости от типа медицинского или коммерческого предприятия, на котором вы работаете, вы можете предоставлять населению некоторые или даже все виды контроля миопии, а также обладать доступом ко всем описанным в статье измерительным приборам. Тем не менее по-прежнему важно обсуждать проблему близорукости с пациентами и иметь связь с коллегами, активно работающими в этой сфере. В наши дни правильным будет предлагать подходящие методы контроля миопии нашим пациентам, исходя из их возраста, стиля жизни, текущего статуса рефракции и скорости роста глаза. Использование оптических биометров расширяет наши профессиональные возможности и вооружает знаниями для выбора оптимальной стратегии контроля миопии.
Список литературы
Автор:
Никола Логан (Nicola Logan), доктор философии, научный директор офтальмологической исследовательской группы, преподаватель оптометрии кафедры наук о жизни и здоровье Астонского университета (Бирмингем, Великобритания)
Перевод: И. В. Ластовская
Статья опубликована в журнале Optometry Today 15.03.2018. Перевод печатается с разрешения редакции
© РА «Веко»
Печатная версия статьи опубликована в журнале «Современная оптометрия» [2021. № 5 (144)].
По вопросам приобретения журналов и оформления подписки обращайтесь в отдел продаж РА «Веко»:
- Тел.: (812) 603-40-02.
- E-mail: magazine@veko.ru
- veko.ru
Наши страницы в соцсетях: