В этой статье описывается случай акантамебного кератита с точки зрения как врача-офтальмолога, так и пациента, что дает уникальное представление о влиянии этого редкого, но тяжелого заболевания.
Введение
Микроорганизм Acanthamoeba (акантамеба) может существовать в двух формах: трофозоиты или цисты, первая – инфекционная, она способна активно вызывать повреждение поверхности глаза, приводящее к кератиту. Цисты неактивны, акантамеба закрывается в двойную оболочку, и уничтожить ее становится очень сложно; в литературе отмечается, что в такой форме эти микроорганизмы могут сохраняться живыми до 20 лет [1]. Все это усложняет терапию, поскольку требуется постоянное наблюдение за пациентом, и не всегда лечение достигает своей цели.
На первой стадии болезни акантамебный кератит (АК) напоминает герпетический: на роговице отмечается диффузная верхняя псевдодендритоформовая эпителиопатия. В Германии до 47 % случаев АК были ошибочно диагностированы врачами-офтальмологами как герпетический кератит [2, 3]. Ретроспективное исследование, проведенное в Великобритании, показало, что 52,3 % пациентов с АК вначале был неверно поставлен диагноз «герпетический кератит» [4]. В итоге назначалось неподходящее лечение и наблюдалось отсутствие результатов действия антивирусных препаратов, что затягивало постановку правильного диагноза. Когда инфекция переходит на строму, в таких случаях пациентам назначают кортикостероиды, а они ассоциируются с четырехкратным повышенным риском ухудшения зрения [4].
По мере прогрессирования заболевания акантамебы размножаются по всей поверхности роговицы, выделяя цитотоксические химические вещества, которые позволяют им проникать через эпителий в строму. Мультифокальные стромальные инфильтраты можно наблюдать при биомикроскопии с помощью щелевой лампы, они аналогичны тем, которые обнаруживаются при бактериальном кератите, вызванном синегнойной палочкой [5]. Периневральные инфильтраты могут возникать при обоих заболеваниях, когда бактерии или амебы размножаются вдоль нервов роговицы [6]. Таким образом, от 2 до 3 % случаев АК были ошибочно диагностированы как бактериальный кератит [2, 3]. АК также может быть принят за грибковый кератит [2, 3], поскольку существуют частично дублирующие знаки, относящиеся в общем к кератитам, например кольцевой инфильтрат и другие неспецифические признаки [5]. Аналогичным образом коварен грибковый кератит, и его трудно диагностировать, когда противогрибковая терапия демонстрирует токсичность, препятствуя заживлению ран на роговице [7].
Классические признаки АК, включая кольцевой инфильтрат, также называемый «иммунным кольцом Вессли», не дают о себе знать до поздней стадии заболевания, когда прогноз неблагоприятный. Тем не менее этот характерный признак наблюдается только в 50 % случаев и не ограничивается АК, поэтому на него нельзя полагаться в качестве диагностического признака. Многие люди, носящие контактные линзы (КЛ), привыкли испытывать небольшие раздражения глаз и, следовательно, могут не обращаться за лечением АК до далеко зашедшей стадии заболевания, что влияет на прогноз [5].
Хотя АК обычно диагностируется неправильно, вторичные или сопутствующие инфекции не являются редкостью, вирус, бактерии или грибы регистрируются на глазу наряду с акантамебой в 23 % случаев [3]. Это увеличивает микробную нагрузку на глаз, поскольку бактерии становятся источником пищи для акантамебы, которая размножается все активнее, проникая глубже в роговицу. Такая микробная нагрузка ставит под угрозу целостность глазной поверхности и эпителия роговицы, повышая вероятность вторичной инфекции, поскольку барьер, защищающий глаз от нее, теряет свою прочность.
К сожалению, окончательный диагноз АК часто устанавливается только через 2,8 ± 4 месяца (диапазон 0–23 месяца) после первоначальных клинических проявлений [2, 3]. Эта задержка в постановке диагноза служит значительным фактором в результатах течения заболевания. В обзоре отмечается, что золотой стандарт диагностики – посев или соскоб роговицы, являющийся инвазивной процедурой [8]. Недавно появились неинвазивные методы, при этом конфокальная микроскопия in vivo и полимеразная цепная реакция демонстрируют специфичность 100 и 75 % соответственно по сравнению с культурами роговицы [9]. Эти методы потенциально могут сыграть полезную роль в будущей диагностике АК.
Случай из практики
Жительница Лондона в возрасте 31 года обратилась за медицинской офтальмологической помощью в 2011 году, была обследована, ей поставили диагноз АК, и она проходит лечение с того времени в Глазной больнице Мурфилдс. Пациентке был проведен целый ряд процедур, в том числе две проникающие кератопластики, чтобы сохранить ее правый глаз. Начальные симптомы включали в себя сильную светобоязнь, чрезмерное слезотечение и ощущение песка в правом глазу. Это было быстро диагностировано как АК из-за царапины на роговице. Женщина не могла вспомнить ни одного недавнего контакта с водой, ни каких-либо возможных причин инфекции. Знаки со стороны переднего отрезка глаза, отмечаемые на протяжении всего течения заболевания: дефект эпителия диаметром до 6 мм, периневральные инфильтраты, отек роговицы, утолщение стромы, клеточную реакцию передней камеры и вскоре последовавший за ней склерит.
Пациентка носила КЛ более 10 лет, и у нее отмечалось хорошее соблюдение инструкций по уходу за ними. К моменту постановки диагноза она носила однодневные гидрогелевые мягкие контактные линзы (МКЛ), изготовленные из материала нелфилкон А, и не применяла никаких дополнительных средств для ухода за ними или их хранения. По ее словам, она не спала в КЛ и не перенашивала их дольше одного дня. Согласно данным Глазной больницы Мурфилдс, факторами риска при ношении линз являются плавание в КЛ (под очками для плавания) и сон в них продолжительностью до 15 мин.
На первом этапе терапии ей назначили местный антибиотик в виде глазных капель (левофлоксацин 0,5 %) до подтверждения диагноза АК. Антиамебное лечение началось через девять дней после появления симптомов – применен полигексаметиленбигуанид (PHMB), а позже был добавлен хлоргексидин. Этот режим терапии и его вариации продолжались более трех лет, при этом интенсивность лечения изменялась в зависимости от клинической картины. Местные стероиды, включая дексаметазон и Pred Forte, были назначены через 20 дней после начала антиамебного лечения, а вскоре последовал пероральный прием преднизолона. Из-за тяжести проявления инфекции в течение двух месяцев после появления симптомов были применены перорально противогрибковый препарат вориконазол и иммунодепрессант циклоспорин. Пероральные анальгетики использовались для обезболивания, а гоматропин и зопиклон – для лечения симптомов светобоязни и бессонницы, вызванной стероидами, соответственно.
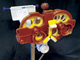
Спустя пару месяцев после дебюта АК развился склерит, ассоциированный с акантамебной инфекцией (рис. 1). Знаки тяжелой стадии склерита включают в себя катаракту и заднее утолщение склеры. Пациентка жаловалась на боль – ей были назначены системные стероидные препараты и иммунодепрессанты: метилпреднизолон, микофенолат и такролимус. В качестве терапии склерита рассматривалась и химиотерапия, однако пациентка планировала беременность, и поэтому этот вариант не подходил. В итоге ей назначили инфликсимаб – вводимый внутривенно препарат, часто применяемый при лечении аутоиммунных заболеваний в целях контроля тяжело протекающего склерита. Инфликсимаб содержит химерные антитела, которые связываются с провоспалительными факторами некроза опухоли (TNF-альфа), уменьшая ее воздействие на эндотелиальные клетки сосудов.

Рис. 1. Акантамебный склерокератит
Снимок Ирени Эккешис (Irenie Ekkeshis)
В мае 2013 года пациентке провели сквозную кератопластику из-за опасений перфорации, вызванной утончением роговицы. Острота зрения у нее перед операцией была низкой: правым глазом она могла различать лишь движение руки в поле зрения. АК продолжал рецидивировать после пересадки трансплантата, все это сопровождалось непрерывным противоамебным и противовоспалительным лечением. Сюда включалось внутривенное введение микофенолата в дозе 1 г утром и 1,5 г вечером и пероральный прием доксициклина в дозе 100 мг ежедневно в качестве профилактики таяния роговицы. Бетаметазоновая мазь использовалась четыре раза в день для контроля воспаления, пероральный моксифлоксацин – четыре раза в день для профилактики вторичной инфекции и местный PHMB 0,02 % – тоже четыре раза в день в качестве антиамебного лечения.
По завершении воспалительного процесса в октябре 2013 года был проведен роговичный кросс-линкинг в целях стабилизации состояния роговицы, а в июне 2014-го – вторая кератопластика (рис. 2). Во время нее пришлось задействовать глубокую ламеллярную кератопластику, поскольку эпителизации роговицы не произошло и существовал высокий риск ее перфорации. В сентябре 2014 года случилось отторжение трансплантата, но ситуацию удалось спасти путем местного применения Pred Forte каждые два часа и профилактического использования хлоргексидина шесть раз в день.

Рис. 2. Акантамебный склерокератит и сквозная кератопластика
Снимок Ирени Эккешис (Irenie Ekkeshis)
Глазная гипотония у пациентки неожиданно развилась в начале 2014 года, женщина жаловалась на дискомфорт в глазах при отсутствии воспаления, УЗИ показало отслойку цилиарного тела. Спонтанное восстановление от гипотонии было отмечено два года спустя, в апреле 2015-го, когда наблюдалось повышение внутриглазного давления с 0 до 7 мм рт. ст. В августе 2020 года было зарегистрировано внутриглазное давление 28 мм рт. ст. в правом глазу после эпизода отслойки сетчатки в нем, для снижения давления был назначен латанопрост.
Ботулинический токсин использовался для индуцирования птоза в правом глазу, это было нужно, чтобы ограничить движение века поверх стойких эпителиальных дефектов роговицы. Другие последствия АК включали в себя правостороннюю экзотропию, которая была выявлена в Глазной больнице Мурфилдс, но никаких дальнейших действий по этому поводу предпринято не было.
С 2019 года трансплантат роговицы остается стабильным благодаря тщательному лечению, в которое входит применение местных стероидов, профилактических антибиотиков и глазных смазок. При терапевтическом лечении в этом случае также учитывалось, что пациентка беременна, принимает преднефрин после ЭКО и имеет ограничения по применению фторхинолонов. Она носит бандажную КЛ в пролонгированном режиме (две недели подряд) для улучшения косметического эффекта и купирования симптомов, связанных с дефектами эпителия. Женщине был изготовлен протез, и она носила его время от времени, но нечасто из-за сопутствующих раздражений. Во время визита в сентябре 2020 года пациентка показала в целом стабильные результаты, правым глазом она могла воспринимать свет, острота зрения на левом глазу была 1,2.
Течение болезни с точки зрения пациентки
Мне поставили диагноз АК еще в 2011 году, после недели пугающих симптомов в моем правом глазу, среди которых была боль, светочувствительность, чрезмерное слезотечение и ощущение зернистости. После ряда анализов, включая соскоб роговицы, я в конце концов получила подтвержденный диагноз – АК.
Доктора назначали капли с PHMB ежечасно днем и ночью на ранних стадиях, после чего их количество уменьшалось. Мне сказали, что обезболивающие помогут справиться, и посоветовали приготовиться к долгому лечению. Через несколько месяцев у меня развился склерит, который, как полагают, был вызван аутоиммунной реакцией на инфекцию, из-за чего я еще больше расстроилась.
Врачи прописали высокие дозы стероидов, и это принесло облегчение на несколько недель. Но в конце концов пероральные лекарства просто перестали работать, поэтому врачи начали вводить стероиды внутривенно. Эти препараты избавляли от боли, но делали меня гиперактивной. Я не спала по ночам, сердце бешено колотилось, в ушах звенело, и невозможно было обрести никакого покоя. А потом инъекции перестали действовать, и боль вернулась, она как будто сжимала мой правый висок тисками. Врачи объяснили, что мы подходим к окончательному варианту – курсу химиотерапии, прохождение которого может помочь остановить склерит, или придется применить самое последнее средство – удаление глаза.
Лечащие врачи обратились к регулятору за разрешением на использование препарата, который никогда ранее не применялся в случае глазной инфекции. Мне сделали девять инъекций инфликсимаба, что положило конец жгучей боли, которую я испытывала ежедневно. Ее приступы продолжались, ослаблялись препаратами, но все еще оставались в течение нескольких дней, а затем проходили. Это тянулось и тянулось без конца, приступы сменялись периодами затишья, длившимися месяцами.
Другие проблемы потребовали совершенно иного протокола лечения, включающего в себя наложение бандажа, закапывание смазывающих глазных капель и введение ботулинического токсина, чтобы вызвать птоз века. У меня было по крайней мере две вторичные инфекции – синегнойная палочка и коринебактерия – обе, к счастью, поддались лечению антибиотиками.
После полутора лет интенсивного лечения глаз стал «покойным», но через несколько месяцев врачи обнаружили течь в моей роговице, что потребовало экстренной ее пересадки.
Очнувшись от наркоза, я услышала, что все прошло хорошо. Я моргнула и посмотрела через мою недавно пересаженную роговицу и, к своему изумлению, увидела большую букву А в верхней части таблицы с буквами. Невероятно. Еще одно моргание, и в поле зрения появился следующий ряд букв – Z, N. Затем, не веря своим глазам, я направила взгляд на следующий ряд – D, O, E. Я могла видеть.
Ровно 14 дней спустя я проснулась и обнаружила, что часть моего глаза снова затуманилась. Болезненное ощущение песка вернулось вместе со стреляющими болями и слезоточивостью глаз, которые были хрестоматийными симптомами, я не могла их игнорировать. Мой лечащий врач-офтальмолог подтвердил, что да, к сожалению, он может «увидеть признаки цист акантамебы на стыке “трансплантат – реципиент”». Какие разрушительные, душераздирающие новости! Мы снова вернулись к исходной точке.
Следующие несколько месяцев – это череда новых вмешательств, различных по силе экспериментальных глазных капель, интернет-исследований и отчаяния. Последним ударом стала неожиданная потеря глазного давления, вероятно, вызванная всплеском воспаления в задней части глаза, – признак того, что после всех травм, капель, операций и воспалений глаз сдался. Мне сказали, что на этот раз уже ничего нельзя было сделать. Я больше никогда не буду видеть правым глазом.
Обсуждение
Склерит, ассоциируемый с акантамебой
Хотя АК – это первичное заболевание, у пациентов с ним в тяжелой стадии обычно наблюдаются другие глазные болезни, в частности увеиты, склериты и ретинальные васкулиты. Из-за этих воспалительных состояний врачи-офтальмологи назначают высокие дозы стероидных препаратов и иммунодепрессантов, что увеличивает риск развития задней субкапсулярной катаракты и других системных проблем в организме, например гипертензии [10].
Судя по оценкам, вторичный склерит встречается примерно в 10 % случаев АК [11]. Его патогенез недостаточно хорошо документирован из-за редкости заболевания, и есть немного доказательств для заключения, что он связан с инвазией склеры амебой, вызывающей иммунологический ответ [11]. Склерит имеет тяжелые симптомы, когда пациенты испытывают «сверлящую» боль в глазах, которая распространяется по всему лицу, с клиническими признаками закупорки сосудов и воспаления склеральной ткани. К счастью, это заболевание относительно хорошо поддается терапии в 90 % случаев, его лечат нестероидными противовоспалительными препаратами (НПВП), стероидами и дополнительными иммуносупрессивными препаратами, такими как циклоспорин. Химиотерапия может быть рассмотрена в неэффективных случаях [12]. В безуспешных ситуациях возможным исходом является энуклеация.
Прикрепление амеб к однодневным КЛ
Когда развилась инфекция, пациентка пользовалась однодневными КЛ из нелфилкона А, неионного гидрогелевого материала с высоким содержанием влаги (вторая группа по классификации FDA). Исследование выявило значительные различия между количеством прикрепленных акантамеб среди четырех групп гидрогелевых линз по классификации FDA, его результаты свидетельствуют о том, что ионность является наиболее важным фактором, в то время как высокое содержание влаги способствует прилипанию как цист, так и трофозоитов амебы [13]. Наибольшая адгезия наблюдалась в ионных материалах с высоким содержанием влаги (четвертая группа) [13, 14]. При сравнении неионных материалов с низким (первая группа) и высоким (вторая группа) содержанием влаги бóльшее прикрепление наблюдалось на поверхности тех КЛ, которые имели более высокое ее содержание [13]. Риск возникновения микробного кератита у тех, кто ежедневно носит однодневные КЛ, аналогичен тому, которому подвержены пользователи линз плановой замены; однако степень его тяжести ниже по сравнению со степенью риска при ношении линз многоразового применения [15]. Использование ежедневных одноразовых линз также может снизить вероятность заражения, связанную с растворами для КЛ и контейнерами для их хранения. В многочисленных исследованиях сообщалось, что контейнеры – наиболее загрязненные предметы в режиме ухода за линзами: они имеют уровень микробного загрязнения более 50 % [16, 17]. В то время как однодневные линзы устраняют необходимость использования контейнеров для хранения и растворов, хотя могут возникнуть и другие возможности для несоблюдения требований.
Опрос, проведенный в США, показал следующее: 99 % тех, кто носит КЛ, неправильно их используют, что увеличивает риск нежелательных явлений [18]. О привычках спать в линзах и продлении рекомендуемого графика замены сообщили более половины участников. Почти 85 % людей признались, что принимали душ в КЛ, а 61 % – плавали в них, что представляет большой риск развития АК [18].
Обзор подобных случаев
Исследование, проведенное в Глазной больнице Мурфилдс в период с января 2010-го по январь 2011 года, показало, что у 18,5 % из 178 пациентов (100 %) с АК наблюдался ассоциированный склерит [11]. Bо всех случаях пациентов со склеритом 69 % имели тяжелые формы заболевания и нуждались в системной иммуносупрессивной терапии. Алгоритм лечения акантамебного склерокератита в Глазной больнице Мурфилдс основан на «стремянном подходе», когда первоначальное лечение включает в себя местные стероиды и пероральные НПВП, а в тяжелых случаях добавляется пероральный стероид [11]. Циклоспорин и/или микофенолат используются, чтобы избежать длительного применения стероидов, а в особо трудных ситуациях назначается внутривенное введение метилпреднизолона. 72 % пациентов с тяжелой степенью склерита нуждались в проникающей кератопластике по сравнению с 21 % от общего числа пациентов со склеритом, перенесших проникающую кератопластику. 29 % пациентов потребовалось более одной процедуры кератопластики, у всех них был тяжелый акантамебный склерокератит [11].
Другие сообщения об акантамебном склерокератите в литературе описывают случай женщины в возрасте 41 года, которая долгое время пользовалась однодневными МКЛ [19]. Пациентка своевременно меняла линзы на новые, не перенашивала их. Склерит возник через месяц после первоначального проявления симптомов и в итоге привел к энуклеации пораженного глаза после агрессивной иммуносупрессивной терапии и рецидивирующей инфекции акантамебы [19].
В еще одном исследовании подробно описан случай рецидива акантамебного склерокератита у 30-летнего мужчины, пользующегося МКЛ, который вызвал у него эндофтальмит, в свою очередь приведший к энуклеации [20]. Было начато антиамебное и противогерпетическое лечение и проведены две процедуры проникающей кератопластики. Стабильные результаты наблюдались через год после начала заболевания; однако вскоре узловой склерит повторился, и акантамебы в форме цист и трофозоита были обнаружены во всех слоях глаза [21].
Интересно, что существует очень похожий случай не поддающегося терапии АК у 48-летней женщины, ежедневно пользующейся одноразовыми МКЛ, у которой в течение двух недель наблюдались светобоязнь, боль и слезотечение в левом глазу [12]. Хотя первоначальное лечение с применением PHMB и пропамидина изетионатом (броленом) было успешным и никаких признаков кератита не наблюдалось, через месяц возник склерит. Первоначально его лечили пероральными НПВП и стероидами, но безрезультативно. Впоследствии внутривенно вводили стероиды в сочетании с другим иммунодепрессантом, циклоспорином А, в присутствии спокойной роговицы. Однако это не имело достаточной эффективности, поэтому были применены дополнительные иммунодепрессанты, циклофосфамид и адалимумаб. К сожалению, у пациента проявились рецидивирующий кератит и множественные побочные эффекты системных стероидов и иммунодепрессантов, что привело к увеличению применения местного PHMB и бролена при одновременном снижении использования стероидов, добавлении перорального иммунодепрессанта такролимуса и антигипертензивных средств для борьбы с ними. Следовательно, очевидно, что существует тонкая грань между лечением АК и его вторичными побочными эффектами в виде ассоциированного склерита. В конце концов склерит пациентки лечили с помощью четырех сопутствующих иммунодепрессантов: преднизолона, такролимуса, циклофосфамида и адалимумаба. Острота зрения в пораженном глазу была снижена до счета пальцев из-за сочетания задней субкапсулярной катаракты и помутнения стромы по причине рецидива АК. Женщина продолжает принимать стероиды и иммунодепрессанты, чтобы контролировать склерит. Другой глаз не затронут [12].
Заключение
АК – это тяжелое заболевание с плохим прогнозом, особенно из-за его вторичных осложнений в виде ассоциированного склерита и побочных эффектов от лекарств, используемых в процессе лечения. Несмотря на своевременно поставленный диагноз в приведенном случае и успешное начальное лечение первичного АК, конечный визуальный результат был неудовлетворительным: острота зрения находится лишь на уровне восприятия света. Для тех, у кого нет вторичных осложнений, прогноз остается неблагоприятным из-за трудностей с полным уничтожением акантамеб и вероятности повторного заражения.
Склерит является потенциальным вторичным последствием, которое часто требует приема целого «коктейля» препаратов из стероидов и иммунодепрессантов в течение длительного периода, что приводит как к системным, так и к глазным побочным эффектам. Кроме того, рецидивирующий АК не является редкостью даже после трансплантации роговицы. Это замыкается в порочный круг лечения и мониторинга побочных эффектов от него. Следовательно, возникает непростая задача – подобрать пациенту наиболее подходящее ему лечение.
В описанном клиническом случае тяжелое течение заболевания у пациентки, несмотря на отсутствие явных факторов риска, подчеркивает важную роль, которую практикующие врачи-офтальмологи и оптометристы играют в обучении гигиене КЛ. Хотя невозможно полностью исключить риск возникновения заражения, его можно значительно снизить, подчеркнув важность отсутствия контакта с водой при надетых КЛ, а также соблюдения гигиены рук перед манипуляциями с линзами. Пациентка разработала концепцию наклейки «Не допускать контакта с водой», помещаемой на упаковки КЛ, поскольку она была мотивирована своим опытом и недостаточной осведомленностью общественности о последствиях такого контакта (рис. 3). Она лоббировала свое изобретение в Британской ассоциации контактных линз (BCLA), члены которой согласились добавить графическое изображение перечеркнутого крана с водой на свои наклейки «Правая» и «Левая» для упаковок КЛ. Рандомизированное контролируемое исследование, проверяющее эффективность этих наклеек, дало положительный результат [21]. В настоящее время наклейки доступны в США, Австралии, Новой Зеландии и Великобритании, а символ перечеркнутого крана стал частью инициативы Международной организации по стандартизации (ISO) по добавлению его на упаковки КЛ еще на этапе производства.

Рис. 3. Стикеры «Не допускать контакта с водой», пролоббированные пациенткой в BCLA
Список литературы
1. Sriram R, Shoff M, Booton G, et al. Survival of Acanthamoeba cysts after desiccation for more than 20 years. J Clin Microbiol 2008 46 (12): 4045–8.
2. Daas L, Szentmary N, Eppig T, et al. [The German Acanthamoeba keratitis register: Initial results of a multicenter study]. Ophthalmologe 2015 112 (9): 752–63.
3. Szentmary N, Daas L, Shi L, et al. Acanthamoeba keratitis – Clinical signs, differential diagnosis and treatment. J Curr Ophthalmol 2019 31 (1): 16–23.
4. Robaei D, Carnt N, Minassian DC, Dart JK. The impact of topical corticosteroid use before diagnosis on the outcome of Acanthamoeba keratitis. Ophthalmology 2014 121 (7): 1383–8.
5. Lorenzo-Morales J, Khan NA, Walochnik J. An update on Acanthamoeba keratitis: diagnosis, pathogenesis and treatment. Parasite 2015 22: 10.
6. Carnt N, Samarawickrama C, White A, et al. The diagnosis and management of contact lens-related microbial keratitis. Clin Exp Optom 2017 100 (5): 482–93.
7. Kimakura M, Usui T, Yokoo S, et al. Toxicity of topical antifungal agents to stratified human cultivated corneal epithelial sheets. J Ocul Pharmacol Ther 2014 30 (10): 810–4.
8. Carnt N, Stapleton F. Strategies for the prevention of contact lens-related Acanthamoeba keratitis: a review. Ophthalmic Physiol Opt 2016 36 (2): 77–92.
9. Goh JWY, Harrison R, Hau S, et al. Comparison of In Vivo Confocal Microscopy, PCR and Culture of Corneal Scrapes in the Diagnosis of Acanthamoeba Keratitis. Cornea 2018 37 (4): 480–5.
10. Shi L, Hager T, Fries FN, et al. Reactive uveitis, retinal vasculitis and scleritis as ocular end-stage of Acanthamoeba keratitis: a histological study. Int J Ophthalmol 2019 12 (12): 1966–71.
11. Iovieno A, Gore DM, Carnt N, et al. Acanthamoeba sclerokeratitis: epidemiology, clinical features, and treatment outcomes. Ophthalmology 2014 121 (12): 2340–7.
12. Igras E, Murphy C. Use of multiple immunosuppressive agents in recalcitrant ACANTHAMOEBA scleritis. BMJ Case Rep 2015 2015.
13. Seal DV, Bennett ES, McFadyen AK, et al. Differential adherence of Acanthamoeba to contact lenses: effects of material characteristics. Optom Vis Sci 1995 72 (1): 23–8.
14. Simmons PA, Tomlinson A, Connor R, et al. Effect of patient wear and extent of protein deposition on adsorption of Acanthamoeba to five types of hydrogel contact lenses. Optom Vis Sci 1996 73 (6): 362–8.
15. Dart JKG, Radford CF, Minassian D, et al. Risk Factors for Microbial Keratitis with Contemporary Contact Lenses: A Case-Control Study. Ophthalmology 2008 115 (10): 1647–54.e3.
16. Wu YT-Y, Willcox M, Zhu H, Stapleton F. Contact lens hygiene compliance and lens case contamination: A review. Contact Lens and Anterior Eye 2015 38 (0): 307–16.
17. Yung MS, Boost M, Cho P, et al. Microbial contamination of contact lenses and lens care accessories of soft contact lens wearers (university students) in Hong Kong. Ophthalmic Physiol Opt 2007 27 (1): 11–21.
18. Cope JR, Collier SA, Rao MM, et al. Contact Lens Wearer Demographics and Risk Behaviors for Contact Lens-Related Eye Infections – United States, 2014 MMWR 2015 64 (32): 865–70.
19. Ebrahimi KB, Green WR, Grebe R, et al. Acanthamoeba sclerokeratitis. Graefes Arch Clin Exp Ophthalmol 2009 247 (2): 283–6.
20. Mammo Z, Almeida DR, Cunningham MA, et al. Acanthamoeba Endophthalmitis after Recurrent Keratitis and Nodular Scleritis. Retin Cases Brief Rep 2017 11 (2): 180–2.
21. Arshad M, Carnt N, Tan J, et al. Compliance behaviour change in contact lens wearers: a randomised controlled trial. Eye (Lond) 2020.
Авторы:
Н. Кэрн,
доктор философии, старший преподаватель в Школе оптометрии и науки о зрении в Университете Нового Южного Уэльса (Австралия)
П. Калаисельван,
доктор философии, постдокторант в Школе оптометрии и науки о зрении в Университете Нового Южного Уэльса (Австралия)
И. Эккешис,
общественный деятель, борец за улучшение осведомленности общественности об опасности акантамебного кератита (Лондон)
Перевод: И. В. Ластовская
Оригинал статьи опубликован в журнале Optometry Today 12.02.2022. Перевод печатается с разрешения редакции
© РА «Веко»
Печатная версия статьи опубликована в журнале «Современная оптометрия» [2022. № 4 (153)].
По вопросам приобретения журналов и оформления подписки обращайтесь в отдел продаж РА «Веко»:
- Тел.: (812) 634-43-34.
- E-mail: magazine@veko.ru
- veko.ru
Наши страницы в соцсетях: